
La chaperona de miosina UNC-45B es esencial para la organización sarcomérica y la función muscular, tanto en organismos sencillos como C.elegans hasta en organismos complejos como los humanos. El impacto patológico de UNC-45B en enfermedades musculares continua siendo difícil de elucidar. En este trabajo se reportan diez variantes bialélicas en UNC45B que resultan en debilitamiento muscular progresivo al inicio de la niñez. La relevancia fisiológica de estos cambios observados se investigaron en transgénicos de C. elegans mediante la expresión de variantes de sentido erróneo conservadas de UNC-45. Como miembro de la familia de proteínas UCS, UNC-45 se identificó por primera vez en C. elegans, revelando que las mutaciones condicionales de pérdida de función dan como resultado un ensamblaje de miofilamento anormal y defectos de locomoción descoordinados.
En placa de 24 pocillos con NGM sembrada con OP50 se colocaron 60 gusanos jóvenes adultos unc-45(m94) expresando las variantes UNC-45. Al alcanzar la edad adulta, para el registro de actividad locomotora se utilizó el sistema ARENA WMicrotracker con regulación de temperatura a 25ºC durante 24 horas. Los datos de motilidad se agruparon en bloques de tiempo de 15 minutos para facilitar la interpretación.
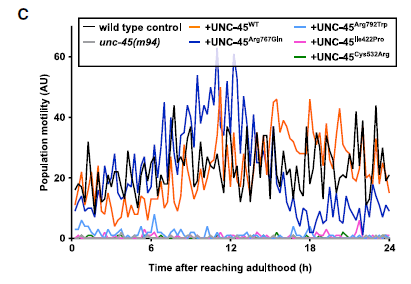
Las proteínas UNC-45B con mutaciones de sentido erróneo relacionadas con la miopatía no pueden rescatar un alelo de pérdida de función condicional. ARENA WMicrotracker fue capaz de registrar los cambios en la actividad locomotora de los distintos transgénicos en una superficie de agar sólido (Figura 6C). Estos datos sugieren que las variantes c.2332C> T (p.Arg778Trp), c.1207T> C (p.Ser403Pro) y c.1540T> C (p.Cys514Arg) muy probablemente afectan la función de la proteína UNC-45B. Por el contrario, la expresión en la cepa unc-45 (m94) de la proteína ortóloga de la variante p.Arg754Gln, UNC-45 (p.Arg767Gln), fue capaz de rescatar el defecto en el movimiento (Figuras 6C).

Am J Hum Genet. 2020 Dec 3;107(6):1078-1095. doi: 10.1016/j.ajhg.2020.11.002. Epub 2020 Nov 19.
Donkervoort S, Kutzner CE, Hu Y, Lornage X, Rendu J, Stojkovic T, Baets J, Neuhaus SB, Tanboon J, Maroofian R, Bolduc V, Mroczek M, Conijn S, Kuntz NL, Töpf A, Monges S, Lubieniecki F, McCarty RM, Chao KR, Governali S, Böhm J, Boonyapisit K, Malfatti E, Sangruchi T, Horkayne-Szakaly I, Hedberg-Oldfors C, Efthymiou S, Noguchi S, Djeddi S, Iida A, di Rosa G, Fiorillo C, Salpietro V, Darin N, Fauré J, Houlden H, Oldfors A, Nishino I, de Ridder W, Straub V, Pokrzywa W, Laporte J, Foley AR, Romero NB, Ottenheijm C, Hoppe T, Bönnemann CG.
