
El propósito de este estudio fue determinar la utilidad del wMicroTracker como plataforma de detección para evaluar la motilidad de varios parásitos. Probamos tres especies de parásitos: las etapas adulta y larvaria del nematodo filarial Brugia pahangi, la etapa de esquistosomula del trematodo Schistosoma mansoni y la etapa de epimastigote del parásito protozoario Trypanosoma cruzi. Utilizando el equipo wMicroTracker se optimizó el ensayo para número de parásitos por pocillo, tipo de placa y el volumen del medio, luego esas lecturas fueron comparadas con el WormAssay cuando fue posible. El WormAssay se ha utilizado en pruebas de detección de fármacos para identificar nuevos compuestos para el tratamiento de la filariasis linfática, la oncocercosis y la esquistosomiasis.
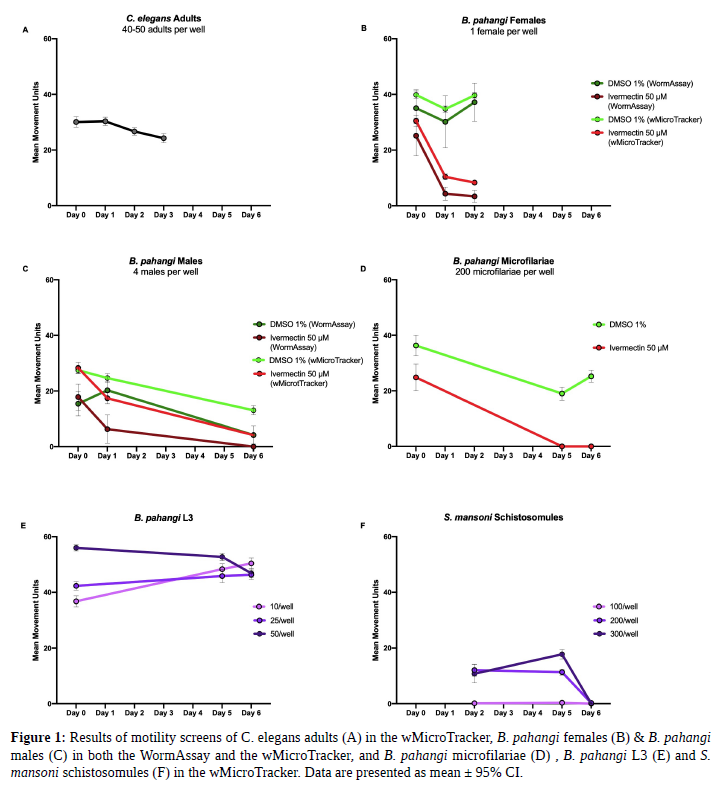
Durante la optimización de los métodos de detección en parásitos con el wMicroTracker, el tamaño y la motilidad de los parásitos de interés se compararon con los adultos de C. elegans (40-50 adultos por pocillo en 100 μL de tampón M9) para asegurar que los pocillos control dieran unidades de movimiento promedio en el rango. Las hembras de B. pahangi (34,7 mm de largo por 139 μm de ancho (muy móviles) se testearon con un gusano por pocillo en 500 μL de RPMI en una placa de fondo plano de 24 pocillos con 8-9 pocillos replicados. Los machos de B. pahangi ( 18,0 mm de longitud por 77 μm de ancho, alta motilidad) con cuatro gusanos por pocillo en 500 μL de RPMI en una placa de fondo plano de 24 pocillos con 4-7 pocillos replicados. Se evaluaron hembras y machos de B. pahangi en ambos sistemas de detección. Se testearon microfilarias de B. pahangi (mf) (177-230 μm de longitud por 5-7 μm de ancho, moderadamente móviles) en el wMicroTracker con 200 mf por pocillo en 100 μL de RPMI en una microplaca de 96U y una placa de fondo plano con la mitad del volumen. Se testearon Mf con 18 pocillos de réplicas por tratamiento donde el control positivo utilizado fue ivermectina 50 μM y el control negativo fue DMSO al 1%. Larvas 3 de B. pahangi (L3) (1-2 mm de largo por 26 μm de ancho, muy móviles) se testearon en el wMicroTracker con 10, 25 y 50 L3 por pocillo en 200 μL de RPMI en microplaca de 96U con 3 réplicas por condición. Esquistosómulos de Schistosoma mansoni (110 μm de largo por 18 μm de ancho, poco móviles) fueron testeadas en el wMicroTracker con 100, 200 y 300 esquistosómulos por pocillo en 100 μL de RPMI en microplaca de 96U con 8 réplica. Los epimastigotes de Trypanosoma cruzi (25,6 μm de largo por 1,9 μm de ancho, moderadamente móviles) también se testearon en el wMicroTracker con 10,000, 50,000 y 100,000 epimastigotes por pocillo en 100 μL de DMEM en microplaca de 96U con 6 réplicas por condición.
A partir de los resultados obtenidos utilizando wMicroTracker y WormAssay, se recomienda que WormAssay se utilice para detectar parásitos de más de 10 mm de longitud y que se utilice wMicroTracker y WormAssay modificado, el «Worminator» para detectar parásitos de menos de 1 mm de longitud. Para parásitos con poca motilidad testeados en el wMicroTracker (p. Ej., Esquistosómulos, B. pahangimf, B. pahangi L3), se recomienda emplear microplaca de 96 pocillos fondo en U para asegurarse de que los parásitos no se depositen a los costados del pocillo. Para parásitos de mayor tamaño que los adultos de C. elegans, se recomienda emplear menos parásitos por pocillo en el wMicroTracker. Para parásitos más pequeños que C.elegans, se recomienda utilizar más parásitos por pocillo. Los epimastigotes de T.Cruzi no fueron detectados en wMicroTracker. Lo ideal es detectar una media de movimiento alrededor de 20-40 por pocillo. Creemos que estos métodos ayudarán a la comunidad de investigadores a desarrollar mejores métodos de detección y acortar el tiempo para optimizar sus plataformas de búsqueda.
MicroPubl Biol. 2020 Jul 20;2020:10.17912/micropub.biology.000279. doi: 10.17912/micropub.biology.000279.
Emma Gunderson , Christina Bulman , Mona Luo , Judy Sakanari
