
Mol Biol Cell. 2015 Jun 1;26(11):2096-111. doi: 10.1091/mbc.E14-05-1009. Epub 2015 Apr 7.
En Caenorhabditis elegans, twitchin es un polipéptido gigante localizado en la banda A del músculo.
La proteína quinasa de twitchin se auto-inhibe por 45 residuos río arriba (NL) y 60 residuos río abajo (CRD) del núcleo catalítico de la quinasa. No está claro cómo se elimina el CRD. Para identificar las proteínas que pueden eliminar el CRD, se realizó un ensayo de doble híbrido en levadura. Una de las proteínas que participan en este proceso es MAK-1, ortólogo en C.elegans de MAPKAP quinasa 2.
El CRD de la proteína twitchin es importante para la unión a MAK-1 (mak-1 se expresa en el músculo de la pared del cuerpo del nematodo). Mientras que los mutantes unc-22 son completamente resistentes a los ensayos con nicotina, los mutantes mak-1 son parcialmente resistentes a la misma. Hay datos genéticos que sugieren la participación de otros dos parálogos de mak-1 (mnk-1 y mak-1) y dos ortólogos de p38 MAP quinasa (pmk-1 y pmk-3).
El ensayo de sensibilidad a nicotina se realizó con animales en estadío joven adulto lavados y resuspendidos en solución tampón M9 en presencia de detergente Tritón X-100 al 0,01% (M9T). En placa de 96 pocillos, se colocaron de 50-100 gusanos por pocillo en un volumen de 50 ul. Los gusanos se dejaron reposar en oscuridad a RT durante 1 hora. La medición se realizó utilizando el equipo WMicrotracker One. La actividad locomotora basal se registró durante 1 hora en ausencia de nicotina. Luego de este primer registro, para el tratamiento, se incorporó por pocillo 50 ul de M9T con nicotina en concentraciones de 0,2 o 0,1% (Testeo al 0,1 o 0,05% en concentración final). Para cada cepa y concentración de la droga se testearon 8 pocillos independientes. Se graficó la actividad locomotora versus tiempo, representándose el valor de la media y su error estándar.
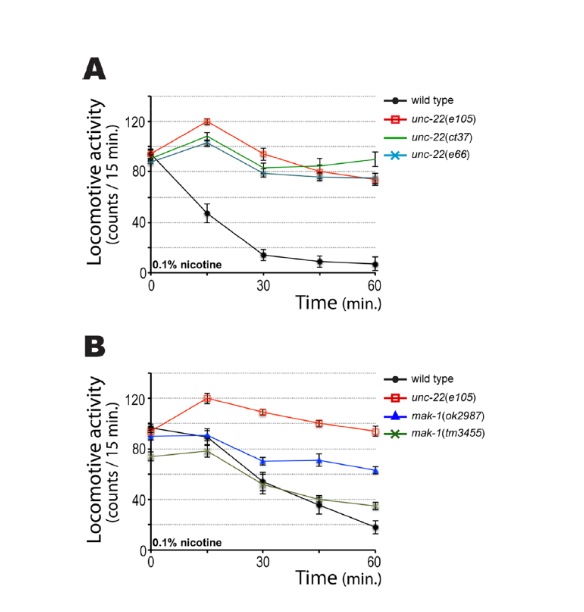
En la figura 7 se observa la respuesta a nicotina de la cepa salvaje, y las cepas mutantes unc-22 y mak-1. Como se muestra en la Figura 7A, cerca del 90% de la cepa salvaje deje de moverse después de aproximademente 30 min. Sin embargo, los mutantes unc-22, independientemente del
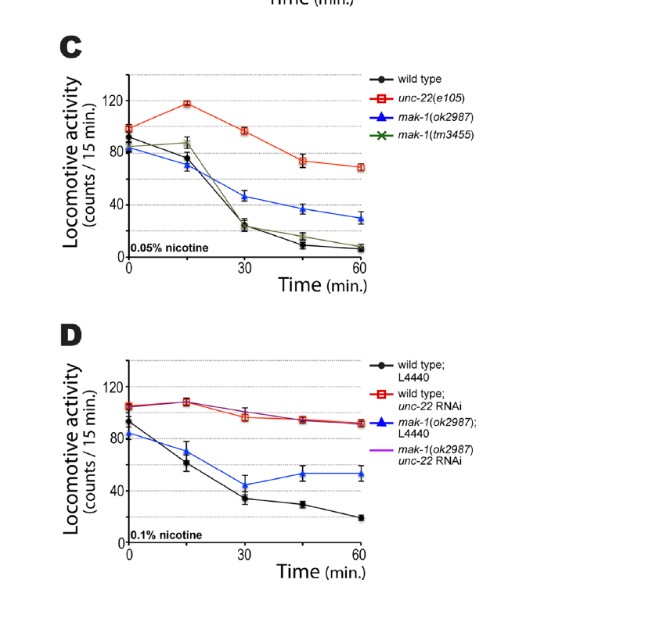
alelo, continúan moviéndose, incluso después de 60 min. En la Figura 7B, los mutantes mak-1 muestran una respuesta intermedia, es decir, son parcialmente resistentes. El alelo nulo mak-1(ok2987) muestra una mayor resistencia que mak-1(tm3445), y este efecto es visible a concentraciones de nicotina de 0,1 o 0,05% (Figura 7C). Debido a que tanto los mutantes unc-22 y mak-1 muestran una respuesta anormal a la nicotina, se quiso analizar cómo respondería el doble mutante. Para ello se alimentó a la cepa salvaje y a mak-1(ok2987) con bacteria productora de ARN de interferencia que silenciara a unc-22. Como se indica en la figura 7D, el doble mutante mak-1(ok2987);unc-22 (RNAi) muestra completa resistencia, al igual que unc-22 (RNAi). Es decir, unc-22 es epistático a mak-1.
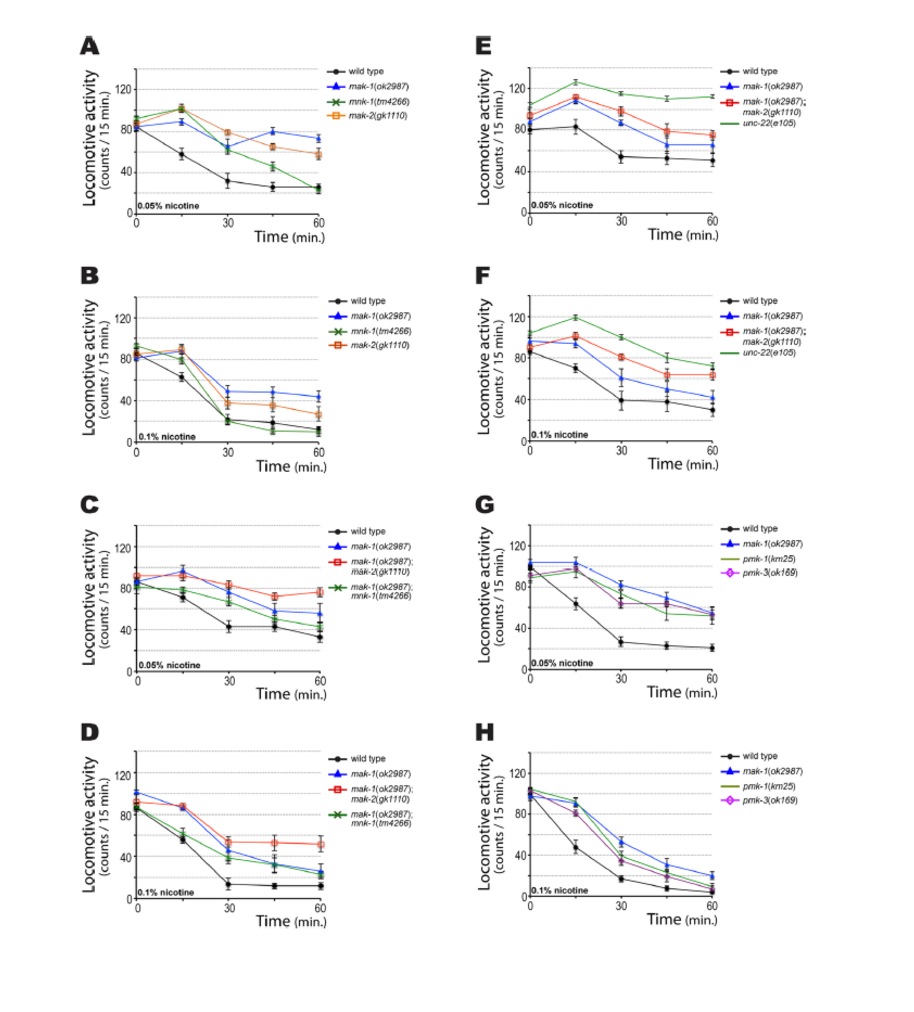
En la figura 9, se observa que Mnk-1, mak-2, pmk-1 y pmk-3 son parcialmente resistentes a la nicotina. Usando los mismos ensayos de WMicrotracker, se observó que mnk-1 y mak-2 son parcialmente resistentes a la nicotina (Figura 9, A y B), y su resistencia se da en el siguiente orden mak-1> mak-2> mnk-1. También se ha analizado la respuesta a nicotina de los dobles mutantes mak-1;mak-2 y mak-1;mnk-1. El mutante mak-1;mak-2 mostró mayor resistencia que el simple mutante mak-1 (Figura 9, C y D), pero menos resistencia que unc-22(e105) (Figura 9, E y F). Estos resultados sugieren que mak-1 y mak-2 contribuyen a la resistencia a la nicotina en la misma vía, pero otros mediadores no identificados también estarían involucrados.
La MAPKAP quinasa 2 de mamífero es fosforilada, y activada, por p38 MAP quinasa. C.elegans codifica para tres p38 MAP quinasas. Sin embargo, una deleción intragénica de pmk-2 es letal en la etapa L1, e impide su análisis con el sistema de registro WMicrotracker. Sin embargo, como se muestra en la Figura 9, G y H, la pérdida de función de pmk-1 o pmk-3 resultó en una resistencia parcial a la nicotina, similar a mak-1.
Este resultado es coherente con el hecho de que pmk-1 y pmk-3 forman parte de la misma vía genética que mak-1.
Leer más: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4472019/
